Этиловый спирт применяется в нашей жизни практически во всех сферах, начиная от получения антисептиков и дезинфицирующих средств, и заканчивая применением в быту в повседневной жизни в качестве вещества, которое поможет растянуть тесную обувь. И для таких целей недостаточно иметь простую водку с содержанием спирта 40%. Для них необходимо использовать максимально чистый спирт. И тут возникает вопрос: Почему же мы получаем спирт с максимальной крепостью 96,6% об. и как добиться большего результата?
Для ответа на эти вопросы необходимо погрузиться в физ.химию процесса.
Физ. химия процесса
Появление и развитие перегонки связано с производством спирта и крепких алкогольных напитков. Исходная смесь (сырье) загружается в перегонный куб и нагревается до температуры начала кипения. Образующиеся пары поступают в конденсатор-холодильник, где переходят в жидкое состояние, а затем охлаждаются. Для квалифицированного управления процессом в куб вмонтирован термометр, с помощью которого можно контролировать отбор фракций с заданными температурами выкипания. После завершения процесса в кубе остается продукт, который называют кубовым остатком или кубовой жидкостью.
Дистилляция
В целях упрощения рассмотрим разделение двухкомпонентной (бинарной) смеси. Из двух компонентов один будет иметь меньшую температуру кипения – спирт. Его мы назовеем низкокипящим компонентом (НКК) и присвоим ему номер 1. Второй компонент, температура кипения которого выше – вода, назовем высококипящим компонентом (ВКК) и присвоим ему номер 2.
Состав бинарной смеси будем выражать в мольных долях НКК и обозначать через Х его концентрацию в жидкой фазе, а через Y – концентрацию в паровой фазе. Понятно, что концентрация второго компонента, ВКК, в жидкой фазе будет (1-х), а в паровой – (1- у).
Итак, взятая исходная смесь в количестве F и с концентрацией НКК ХF нагревается до температуры кипения tнк. При кипении образуется пар состава УD, который после конденсации превращается в жидкий дистиллят с концентрацией НКК ХD. По мере проведения процесса перегонки исходный раствор будет обедняться НКК, так как тот переходит в дистиллят. Поэтому точка М на линии кипения начнет перемещаться вверх и влево, температура кипения будет расти. Вслед за точкой состава кипящей жидкости М будет перемещаться точка состава пара. Концентрация НКК в нем будет уменьшаться.
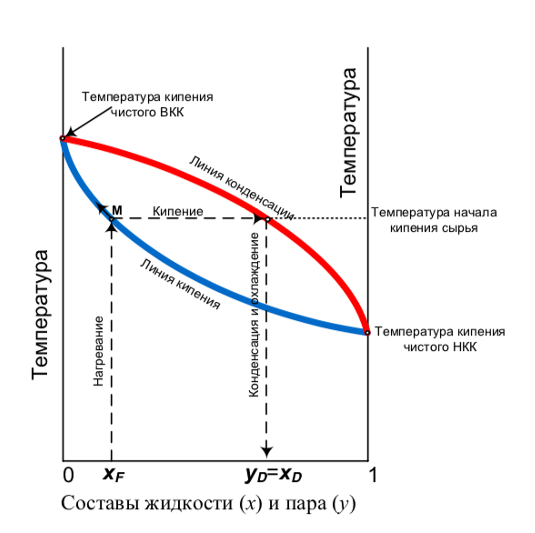
Рис.1 – Процесс простой перегонки на графике парожидкостного равновесия
Данный рисунок описывает процесс перегонки в режиме Pot still (без возврата сконденсированных паров в куб аппарата). Т.е. простыми словами, при кипении исходной смеси концентрация спирта будет увеличиваться, поскольку максимальная концентрация спирта в паровой фазе будет выше, чем в жидкой, при одинаковой температуре и давлении. Таким способом просто переводя исходную смесь в газовую фазу и конденсируя, превращая вновь в жидкую, мы концентрируем наш спирт.
Стоит отметить, что данный способ перегонки не позволит получить концентрацию спирта в дистилляте больше точки, соответствующей составу YD = XD. Это связано с прямой кипения и линией конденсации, поскольку концентрацию получаемого спирта мы будем определять на пересечении этой линии и прямой. Но это не значит, что вы всегда будете в режиме Pot still получать одинаковую крепость продукта на выходе, она будет зависеть от начального содержания спирта в исходной смеси (чем меньше содержание спирта в исходной смеси, тем меньше мы сможем получить концентрацию спирта в конечном продукте, и наоборот).
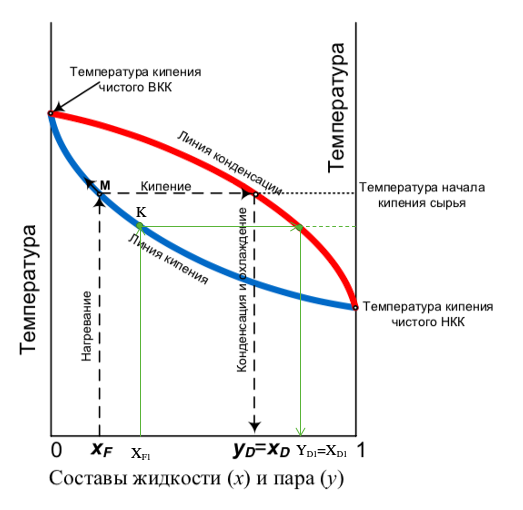
Рис.2 – Сравнение процессов простой перегонки на графике парожидкостного равновесия при различных начальных концентрациях спирта в исходной смеси.
Разберем этот случай на примере: Возьмем исходную смесь XF1, в которой выше концентрация спирта, чем в первом случае XF, следовательно, температура кипения такой смеси будет ниже (Температура кипения – величина интенсивая, поэтому при увеличении концентрации высококипящего компонента она становится выше, а при увеличении концентрации низкокипящего компонента, как в нашем случае, она становится ниже) и при достижении точки кипения К, линия кипения находится ниже линии кипения первого случая, и следовательно, пересечение с линией конденсации произойдет в другом месте. При конденсации паров мы увидим, что концентрация спирта в конечном счете будет выше, чем в первом случае.
Все эти закономерности относятся к простой перегонки без возврата флегмы в куб. Для получения концентрации спирта выше, чем это предписывается равновесием между жидкостью и паром, необходимо применять дефлегмацию и орошение колонны для контактирования флегмы с поднимающимся паром по колонне и «забором» легколетучего компонента вверх колонны. Этот процесс получил название – ректификация.
Ректификация
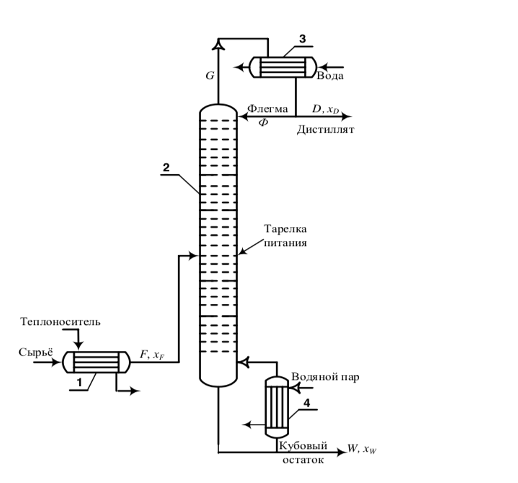
Рис.3 – принципиальная схема ректификационной установки непрерывного действия. 1 – подогреватель сырья; 2 – ректификационная колонна; 3 – конденсатор; 4 – кипятильник.
Главным отличием процесса ректификации от дистилляции является контролируемый возврат флегмы в колонну. На принципиальной схеме видно, что пары низкокипящего компонента (спирта) на выходе из верхней части колонны попадают в конденсатор 3, где конденсируются и делятся на два потока: Поток флегмы Ф и поток дистиллята XD.
Для регулирования процесса ректификации необходимо ввести понятие флегмового числа R, которое будет показывать соотношение потока флегмы, возвращаемого в колонну, к отобранному дистилляту:
R=Ф/XD
Теперь с помощью флегмового числа мы сможем рассчитать концентрацию легкокипящего компонента на выходе из колонны.
Рассмотрим влияние флегмы на график парожидкостного равновесия исходной смеси.
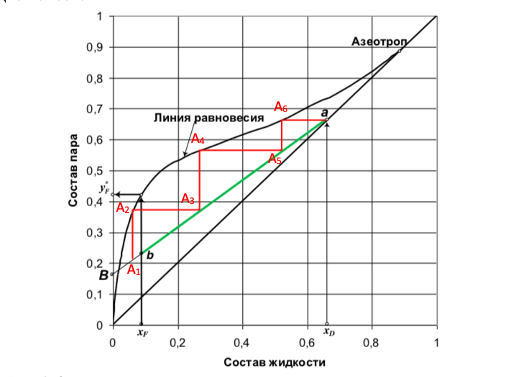
Рис.4 Определение числа теоретических тарелок для разделения смеси вода-этанол.
График аналогичен первому, но построен в координатах по оси Х – состав жидкости, а по оси У – состав пара. (Линия перегона изображена черным цветом. Начало в точке ХF, а конец в точке Y*F).
Теперь разберемся, как влияет флегма на выход продукта. Допустим в кубе у нас находится спирт с концентрацией А1. При кипении исходной смеси пары, поднимающиеся по колонне, будут обогащены спиртом с концентрацией А2 (по графику концентрация спирта составит 35% и ориентироваться уже необходимо по оси У). Если бы у нас была простая перегонка, то это оказалась бы максимальная концентрация спирта, но в процессе ректификации необходимо пары сконденсировать и снова отправить в куб, что соответствует отрезку на графике А2-А3. Следовательно, мы путем испарения и конденсации паров увеличили крепость исходной смеси и теперь может повторить процесс, получив продукт с большей концентрацией спирта. Таким образом, двигаясь то по оси Х, то по оси У, мы достигнем необходимой нам крепости спирта.
Отрезки А2-А3, А4-А5, А6-а являются теоретическими тарелками для разделения нашей исходной смеси. Название теоретические тарелки получили за счет того, что на них образуется равновесие между жидкостью и паром (они являются опорными точками для дальнейшего укрепления продукта А3, А5), но в действительности это равновесие не достигается, поэтому для реализации рассчитанного процесса ректификации требуется реальных тарелок больше, чем теоретических.
Стоит отметить, что для достижения крепости спирта в 80% необходимо всего несколько тарелок, а для достижения крепости 96,6% это значение может достигать в несколько десятков. На рис.5 можно видеть, что тарелки при приближении к максимальной крепости продукта дают уже небольшой прирост по градусам.
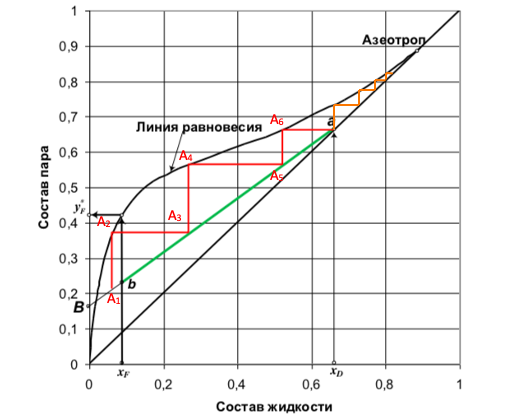
Рис.5 Определение числа теоретических тарелок для разделения смеси вода-этанол.
Методы разделения азеотропных смесей
С помощью ректифицикации можно добиться максимальной крепости спирта 96,6%. Почему нельзя получить спирт с концентрацией 100%? Дело заключается в точке азеотропа, в которой содержание спирта в паровой и жидкой фазах одинаковое. Получается, что испаряя и конденсируя смесь с содержанием спирта 96,6% мы приходим в ту же самую точку и дальнейшее проведение процесса ректификации становится бессмысленным.
Однако для решения сложившейся ситуации есть специальные методы разделения азеотропных смесей.
1. Метод варьирования давления. Этот метод заключается в изменении давления в системе, что позволяет "сдвинуть" точку азеотропа с отметки 96,6. Азеотроп в системе вода-этиловый спирт малоподвижный, поэтому полного его исчезновения не произойдет. Его можно сдвинуть до отметки в 98% при работе под разрежением с абсолютным давлением в 0,05 бар. При работе с таким мощным разрежением необходимо оборудование, которое способно выдержать большие нагрузки. Увеличение давления работает в противоположную сторону, смещая точку азеотропа в левую сторону от отметики 96,6. Поэтому важно, чтобы ваш аппарат имел сообщение с атмоферой не только по причине безопасности, но и также для возможности получения спирта-ректификата.
2. Экстрактивная ректификация. Данный метод основан на изменении относительной летучести компонентов за счет добавления третьего компонента в систему, например, глицерина или этиленгликоля. Используя этот метод вам будет необходимо проводить 3 перегонки вместо привычных двух.
3. Обезвоживание спирта-ректификата соединениями, способными образовывать кристаллогидраты путем связывания молекул воды. Таким соединением может выступать обезвоженный путем прокаливания медный купорос CuSO4. При добавлении его в водно-спиртовую смесь с концентрацией спирта 96,6, он взаимодействует с водой, образуя кристаллогидрат CuSO4*5H2O. Поскольку медный купорос взаимодействует сразу с 5 молекулами воды, то для полного обезвоживания 1 кг. Спирта-ректификата вам потребуется всего лишь 6 грамм CuSO4.
В заключении стоит сказать, что 100% спирт возможно получить только с помощью специальных методов разделения и невозможно получить с помощью дистилляции или ректификации. Метод обезвоживания является наиболее оптимальный для использования в быту, поскольку для его реализации не требуется больших энергетических затрат. При получении такого спирта необходимо понимать для каких целей вы его производите и сопоставлять затраты на его получение, ведь во многих случаях вполне достаточно применения спирта с концентрацией 96,6%.
 0
0


